1. Из перечисленных формул веществ:
выберите молекулярную формула бензола и запишите его структурную формулу.
2. На основе современных представлений об электронных орбиталях и их перекрывании поясните, как образуются химические связи в молекуле бензола.
3. Число σ-связей в молекуле бензола равно:
4) 12
4. Бензол и толуол являются
2) гомологами
5. Структурные формулы, которые приведены ниже, отражают строение
3) трех соединений
6. Вещество, формула которого 
1)1,2,4-трихлорбензол
7. Как получают ароматические углеводороды? Приведите уравнения соответствующих реакций.
1) переработка нефти
2) тримеризация ацетилена над активированным углем
8. Бензол вступает в реакцию замещения с
1) хлором и азотной кислотой
9. Напишите уравнения реакций горения этиленбензола и ксилола.
10. Сравните химические свойства бензола и толуола и поясните сущность взаимного влияния атомов в молекулах. Вспомните соответствующее положение из теории А.М. Бутлерова и приведите другие примеры.
11. Какие мероприятия осуществляются в вашей местности по охране окружающей среды
Сортировка и переработка мусора, охрана водоёмов, лесов.
12. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения:
 13. Напишите уравнения химических реакций, подтверждающих генетическую связь между классами органических соединений в схеме 7.
13. Напишите уравнения химических реакций, подтверждающих генетическую связь между классами органических соединений в схеме 7.
Задача 1. Какой объем воздуха (н.у.) потребуется, чтобы сжечь 1 л бензола, плотность которого 0,88 г/см3?
Задача 2. Сожгли 10,6 г о-ксилола (н.у.). полученный оксид углерода (IV) пропустили через 80 г раствора, в котором массовая доля гидроксида натрия составляет 10 %. Какое вещество образовалось в результате реакций и какова его масса?
Задача 3. Из 13,44 л ацетилена получили 12 г бензола (н.у.). сколько это составляет процентов по сравнению с теоретическим выходом продукта?
Задача 4. К 39 г бензола в присутствии хлорида железа (III) добавили 1 моль брома. Какие вещества получились в результате реакции? каковы их массы?
Первая группа реакций реакции замещения. Мы говорили, что арены не имеют кратных связей в структуре молекулы, а содержат сопряженную систему из шести электронов, которая очень стабильна и придает дополнительную прочность бензольному кольцу. Поэтому в химических реакциях происходит в первую очередь замещение атомов водорода, а не разрушение бензольного кольца.
С реакциями замещения мы уже сталкивались при разговоре об алканах , но для них эти реакции шли по радикальному механизму, а для аренов характерен ионный механизм реакций замещения.
Первое химическое свойство галогенирование. Замещение атома водорода на атом галогена хлора или брома.
Реакция идет при нагревании и обязательно с участием катализатора. В случае с хлором это может быть хлорид алюминия или хлорид железа три. Катализатор поляризует молекулу галогена, в результате чего происходит гетеролитический разрыв связи и получаются ионы.
Положительно заряженный ион хлора и вступает в реакцию с бензолом.
Если реакция происходит с бромом, то катализатором выступает бромид железа три или бромид алюминия.

Важно отметить, что реакция происходит с молекулярным бромом, а не с бромной водой. С бромной водой бензол не реагирует.
У галогенирования гомологов бензола есть свои особенности. В молекуле толуола метильная группа облегчает замещение в кольце, реакционная способность повышается, и реакция идет в более мягких условиях, то есть уже при комнатной температуре.

Важно отметить, что замещение всегда происходит в орто- и пара-положениях, поэтому получается смесь изомеров.
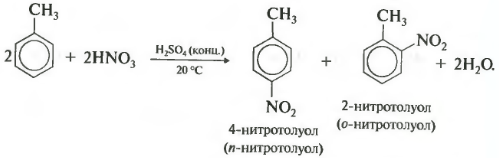
Второе свойство нитрование бензола, введение нитрогруппы в бензольное кольцо.

Образуется тяжелая желтоватая жидкость с запахом горького миндаля нитробензол, поэтому реакция может быть качественной на бензол. Для нитрования используется нитрующая смесь концентрированной азотной и серной кислот. Реакция проводится при нагревании.
Напомню, что для нитрования алканов в реакции Коновалова использовалась разбавленная азотная кислота без добавления серной.
При нитровании толуола, также как и при галогенировании, образуется смесь орто- и пара- изомеров.
Третье свойство алкилирование бензола галогеналканами.

Эта реакция позволяет ввести углеводородный радикал в бензольное кольцо и может считаться способом получения гомологов бензола. В качестве катализатора используется хлорид алюминия, способствующий распаду молекулы галогеналкана на ионы. Также необходимо нагревание.
Четвертое свойство алкилирование бензола алкенами.

Таким способом можно получить, например, кумол или же этилбензол. Катализатор хлорид алюминия.
2. Реакции присоединения к бензолу
Вторая группа реакций реакции присоединения. Мы говорили, что эти реакции не характерны, но они возможны при достаточно жестких условиях с разрушением пи-электронного облака и образованием шести сигма-связей.
Пятое свойство в общем списке гидрирование, присоединение водорода.
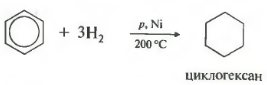
Температура, давление, катализатор никель или платина. Таким же образом способен реагировать толуол.
Шестое свойство хлорирование. Обратите внимание, что речь идет именно о взаимодействии с хлором, поскольку бром в эту реакцию не вступает.
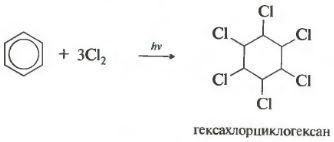
Реакция протекает при жестком ультрафиолетовом облучении. Образуется гексахлорциклогексан, другое название гексахлоран, твердое вещество.
Важно помнить, что для бензола не возможны реакции присоединения галогеноводородов (гидрогалогенирование) и присоединение воды (гидратация).
3. Замещение в боковой цепи гомологов бензола
Третья группа реакций касается только гомологов бензола это замещение в боковой цепи.
Седьмое свойство в общем списке галогенирование по альфа-атому углерода в боковой цепи.

Реакция происходит при нагревании или облучении и всегда только по альфа-углероду. При продолжении галогенирования, второй атом галогена снова встанет в альфа-положение.
4. Окисление гомологов бензола
Четвертая группа реакций окисление.
Бензольное кольцо слишком прочное, поэтому бензол не окисляется перманганатом калия не обесцвечивает его раствор. Это очень важно помнить.
Зато гомологи бензола окисляются подкисленным раствором перманганата калия при нагревании. И это восьмое химическое свойство.

Получается бензойная кислота. Наблюдается обесцвечивание раствора. При этом, какой бы длинной не была углеродная цепь заместителя, всегда происходит ее разрыв после первого атома углерода и альфа-атом окисляется до карбоксильной группы с образованием бензойной кислоты. Оставшаяся часть молекулы окисляется до соответствующий кислоты или, если это только один атом углерода, до углекислого газа.
Если гомолог бензола имеет больше одного углеводородного заместителя у ароматического кольца, то окисление происходит по тем же правилам окисляется углерод, находящийся в альфа-положении.
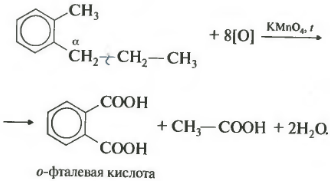
В данном примере получается двухосновная ароматическая кислота, которая называется фталевая кислота.
Особым образом отмечу окисление кумола, изопропилбензола, кислородом воздуха в присутствии серной кислоты.
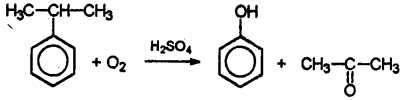
Это так называемый кумольный способ получения фенола. Как правило, сталкиваться с этой реакцией приходится в вопросах, касающихся получения фенола. Это промышленный способ.
Девятое свойство горение, полное окисление кислородом. Бензол и его гомологи сгорают до углекислого газа и воды.
Запишем уравнение горения бензола в общем виде.
По закону сохранения массы атомов слева должно быть столько же, сколько атомов справа. Потому что ведь в химических реакциях атомы никуда не деваются, а просто изменяется порядок связей между ними. Так вот молекул углекислого газа будет столько же, сколько и атомов углерода в молекуле арена, поскольку в состав молекулы входит один атом углерода. То есть n молекул CO 2 . Молекул воды будет в два раза меньше, чем атомов водорода, то есть (2n-6)/2, а значит n-3.
Атомов кислорода слева и справа одинаковое количество. Справа их 2n из углекислого газа, потому что в каждой молекуле два атома кислорода, плюс n-3 из воды, итого 3n-3. Слева атомов кислорода столько же 3n-3, а значит молекул в два раза меньше, потому как в состав молекулы входят два атома. То есть (3n-3)/2 молекул кислорода.
Таким образом, мы составили уравнение сгорания гомологов бензола в общем виде.
Таким соединением, как бензол, госпожа Химия в своем хозяйстве окончательно и бесповоротно обзавелась только в 1833 году. Бензол - это соединение, которое имеет вспыльчивый, можно сказать, даже взрывной характер. Как это выяснили?
История
Иоган Глаубер в 1649 году обратил свое внимание на соединение, которое благополучно образовалось, когда химик занимался обработкой каменноугольной смолы. Но оно пожелало остаться инкогнито.
Спустя около 170 лет, а если быть гораздо более точным, в середине двадцатых годов XIX века, по воле случая из светильного газа, а именно из выделившегося конденсата, извлекли бензол. Таким стараниям человечество обязано Майклу Фарадею, ученому из Англии.
Эстафету по приобретению бензола перехватил немец Эйльгард Мичерлих. Это случилось, когда проходил процесс обработки безводных солей кальция бензойной кислоты. Возможно, поэтому соединению дали такое наименование - бензол. Еще, как вариант, ученый называл его бензином. Благовоние, если в переводе с арабского.
Бензол красиво и ярко горит, в связи с этими наблюдениями Огюст Лоран посоветовал назвать его «фен» или «бензен». Яркий, блистающий - если перевести с греческого языка.
Опираясь на мнение понятие о природе электронной связи, о качествах бензола, ученый предоставил молекулу соединения в виде следующего образа. Это шестиугольник. В него вписана окружность. Вышесказанное говорит о том, что у бензола целостное электронное облако, которое благополучно заключает шесть (без исключения) атомов углерода цикла. Скрепленных бинарных связей не наблюдается.
С бензолом раньше работали как с растворителем. А в основном, как говорится, не состоял, не участвовал, не привлекался. Но это в XIX веке. В XX произошли существенные перемены. Свойства бензола выражают ценнейшие качества, которые помогли ему стать более популярным. Октановое число, которое оказалось высоким, предоставило возможность применять его в качестве элемента топлива для заправки автомобилей. Сие действо послужило толчком обширного изъятия бензола, добыча оного осуществляется как вторичный продукт коксования изготовления стали.
К сороковым годам в химической сфере бензол начал потребляться в изготовлении веществ, которые быстро взрываются. XX век увенчал себя тем, что нефтеперерабатывающая промышленность выработала бензола столько, что стала снабжать химическую индустрию.
Характеристика бензола
Ненасыщенные углеводороды очень схожи с бензолом. Например, углеводородный ряд этилена характеризует себя как ненасыщенный углеводород. Ему свойственна реакция присоединения. Бензол охотно вступает в Все это благодаря атомам, которые находятся в одной плоскости. И как факт - сопряженное электронное облако.

Если в формуле присутствует бензольное кольцо, значит, можно прийти к элементарному выводу, что это - бензол, структурная формула которого выглядит именно так.
Физические свойства
Бензол - это жидкость которая не имеет цвета, зато имеет достойный сожаления запах. Плавится бензол, когда температура достигает 5,52 градусов по Цельсию. Кипит при 80,1. Плотность составляет 0,879 г/см 3 , масса молярная равна 78,11 г/моль. При горении сильно коптит. Формирует взрывоопасные соединения, когда проникает воздух. породы (бензин, эфир и прочие) с описываемым веществом соединяются без проблем. Азеотропное соединение создает с водой. Нагрев до начала парообразования происходит при 69,25 градусов (91 % бензола). При 25 градусах по Цельсию может растворяться в воде 1,79 г/л.
Химические свойства
Бензол реагирует с серной и азотной кислотой. А также с алкенами, галогенами, хлоралканами. Реакция замещения - вот что ему свойственно. Температура давления влияет на прорыв кольца бензола, которое проходит в достаточно резких условиях.
Каждое уравнение реакции бензола мы можем рассмотреть более детально.
1. Электрофильное замещение. Бром, при наличии катализатора, взаимодействует с хлором. В результате получаем хлоробензол:
С6H6+3Cl2 → C6H5Cl + HCl
2. Реакция Фриделя-Крафтса, или алкилирование бензола. Появление алкилбензолов происходит благодаря соединению с алканами, которые являются галогенопроизводными:
C6H6 + C2H5Br → C6H5C2H5 + HBr
3. Электрофильное замещение. Здесь идет реакция нитрования и сульфирования. Выглядеть уравнение бензола будет следующим образом:
C6H6 + H2SO4 → C6H5SO3H + H2O
C6H6 + HNO3 → C6H5NO2 + H2O
4. Бензол при горении:
2C6H6 + 15O2 → 12CO2 + 6H2O
При определенных условиях проявляет характер, свойственный насыщенным углеводородам. П-электронное облако, которое находится в строении рассматриваемого вещества, объясняет эти реакции.
От спецтехнологии зависят различные виды бензола. Отсюда происходит маркировка нефтяного бензола. Например, очищенный и высшей очистки, для синтеза. Хотелось бы отдельно отметить гомологи бензола, а если конкретнее - их химические свойства. Это алкилбензолы.

Гомологи бензола гораздо охотнее реагируют. Но вышесказанные реакции бензола, а именно гомологов, проходят с некоторым отличием.
Галогенирование алкилбензолов
Вид уравнения следующий:
С6H5-CH3 + Br = C6H5-CH2Br + HBr.
Стремление брома в кольцо бензола не наблюдается. Он выходит в цепочку сбоку. Зато благодаря катализатору соли Al(+3) бром смело идет в кольцо.
Нитрование алкилбензолов
Благодаря серной и азотной кислотам нитрируются бензолы и алкилбензолы. Реакционноспособные алкилбензолы. Получаются два продукта из представленных трех - это пара- и орто-изомеры. Можно записать одну из формул:
C6H5 - CH3 + 3HNO3 → C6H2CH3 (NO2)3.
Окисление
Для бензола это неприемлемо. Зато алкилбензолы реагируют охотно. Например, бензойная кислота. Формула приведена ниже:
C6H5CH3 + [O] → C6H5COOH.
Алкилбензол и бензол, их гидрирование
В присутствии усилителя водород начинает реагировать с бензолом, вследствие чего образуется циклогексан, как об этом говорилось выше. Подобным образом алкибензолы без проблем преобразуются в алкилциклогексаны. Для получения алкилциклогексана требуется подвергнуть гидрированию нужный алкилбензол. В основном это необходимая процедура для производства беспримесного продукта. И это далеко не все реакции бензола и алкилбензола.
Производство бензола. Промышленность
Фундамент такого производства зиждется на том, чтобы переработать составляющие: толуола, нафты, смолы, которая выделяется при крекинге угля, и прочих. Посему бензол производится на нефтехимических, металлургических предприятиях. Важно знать, как получить бензол разной степени очистки, ведь от принципа изготовления и предназначения следует прямая зависимость марки данного вещества.
Львиную долю изготавливают термокаталитическим реформингом каустобиолитной части, выкипающей при 65 градусах, обладающей эффектом экстракта, дистилляции с диметилформамидом.
При выработке этилена и пропилена получают жидкие продукты, которые образуются в ходе распада неорганических и органических соединений под воздействием тепла. Из них и выделяют бензол. Но, к сожалению, исходного материала для этого варианта добычи бензола не так уж и много. Потому интересующее нас вещество добывают риформингом. Посредством такого способа объем бензола увеличивается.

Путем деалкилирования при температуре 610-830 градусов со знаком плюс, при наличии пара, образующегося при кипении воды и водорода, из толуола получают бензол. Есть еще вариант - каталитический. Когда наблюдается наличие цеолитов, или, как вариант, катализаторов оксидных, при соблюдении температурного режима 227-627 градусов.
Существует еще один, более старый, способ разработки бензола. С помощью абсорбции поглотителями органического происхождения его выделяют из конечного результата коксования каменного угля. Продукт парогазовый и заранее подвергся охлаждению. Например, в ход пускается масло, источником которого является нефть или каменный уголь. Когда перегонка осуществляется с водяным паром, поглотитель отделяется. Гидроочистка помогает сырой бензол освободить от лишних веществ.
Каменноугольное сырье
В металлургии при использовании каменного угля, а если уточнить - его сухой перегонки, получают кокс. Во время этой процедуры ограничивается поступление воздуха. Не стоит забывать и то, что до температуры 1200-1500 по Цельсию нагревается уголь.
Углехимический бензол нуждается в доскональном очищении. Нужно избавиться в обязательном порядке от метила циклогексана и его товарища н-гептана. тоже должны быть изъяты. Бензолу предстоит процесс разделения, очищения, который будет осуществляться не один раз.
Метод, описанный выше, самый старый, но по истечении времени он теряет свои высокие позиции.
Нефтяные фракции
0,3-1,2 % - такие показатели состава нашего героя в необработанной нефти. Мизерные показатели, чтобы вкладывать финансы и силы. Лучше всего задействовать промышленную процедуру по переработке нефтяных фракций. То есть каталитический риформинг. При наличии алюмо-платино-рениевого усилителя растет процент вмещения ароматических углеводов, и возрастает показатель, определяющий возможности топлива не самовозгораться при его сжатии.
Смолы пиролиза
Если добывать наш нефтепродукт из не твердого сырья, а именно путем пиролиза возникающих при изготовлении пропилена и этилена, то сей подход окажется наиболее приемлемым. Если быть точным, бензол выделяется из пироконденсата. Разложение определенных долей нуждается в гидроочистке. При очистке отстраняются сернистые и непредельные смеси. В исходном результате замечено содержание ксилола, толуола, бензола. С помощью перегона, который является экстактивным, БТК-группа разделяется и получается бензол.

Гидродеалкилирование толуола
Главные герои процесса, коктейль из водородного потока и толуола, подаются нагретыми в реактор. Толуол проходит через пласт катализатора. Во время этого процесса метильная группа отделяется с формированием бензола. Здесь уместен определенный способ очищения. Результатом становится высокочистое вещество (для нитрования).
Диспропорционирование толуола
В следствии отторжения метильного класса совершается созидание до бензола, окисляется ксилол. В данном процессе было замечено переалкилирование. Действие катализации происходит благодаря палладию, платине и неодиму, которые находятся на оксиде алюминия.
В реактор со стойким пластом катализатора подается талуол и водород. Его цель - удержать оседание на плоскость катализатора углеводородов. Поток, который выходит из реактора, подвергается охлаждению, а на рецикл благополучно извлекается водород. То, что осталось, перегоняется трижды. На начальной стадии изымаются соединения, которые являются неароматическими. Вторым добывается бензол, и последний шаг - это выделение ксилолов.
Ацетилена тримеризация
Благодаря трудам французского физико-химика Марселена Бертло из ацетилена стали изготавливать бензол. Но при этом выделялся тяжелый коктейль из многих других элементов. Стоял вопрос, как понизить температуру реакции. Ответ был получен лишь в конце сороковых годов XX века. В. Реппе нашёл соответствующий катализатор, им оказался никель. Тримеризация - это единственный вариант обрести из ацетилена бензол.

Образование бензола происходит с помощью активированного угля. При больших показателях теплоты над углем проходит ацетилен. Бензол выделяется, если температура составляет не менее 410 градусов. При этом еще рождаются разнообразные ароматические углеводороды. Поэтому необходима хорошая аппаратура, которая способна качественно очистить ацетилен. При таком трудоемком способе, как тримеризация, ацетилена расходуется очень много. Чтобы получить 15 мл бензола, берется 20 литров ацетилена. Можно просмотреть, как это выглядит в реакция не заставит себя долго ждать.
3C2H2 → C6H6 (уравнение Зелинского).
3CH → CH = (t, kat) = C6H6.
Где используется бензол
Бензол — это достаточно популярное детище химии. Особенно часто было замечено, как бензол принимали на вооружение в изготовлении кумола, циклогексана, этилбензола. Для создания стирола без этилбензола не обойтись. Исходным материалом для того, чтобы выработать капролактам, служит циклогексан. Изготавливая термопластичную смолу, применяют именно капролактам. Описываемое вещество незаменимо при изготовлении разных красок, лаков.
Насколько опасен бензол
Бензол - это токсичное вещество. Проявление ощущения недомогания, которое сопровождается тошнотой и сильным головокружением - это признак отравления. Не исключается даже летальный исход. Чувство неописуемого восторга - это не менее тревожные звоночки при отравлении бензолом.
Бензол в жидком состоянии вызывает раздражение кожи. Бензольные пары с легкостью проникают даже через неповрежденный кожный покров. При самых недолгосрочных контактах с веществом в небольшой дозе, но на регулярной основе, неприятные последствия не заставят себя долго ждать. Это может быть поражение костного мозга и лейкозы острого характера разного вида.

Ко всему прочему, вещество вызывает зависимость у человека. Бензол действует как дурман. Из табачного дыма получается дегтеобразный продукт. Кода его изучили, то пришли к выводу, что содержание последнего небезопасно для человека. Обнаружилось помимо присутствия никотина еще и наличие ароматических углеводов вида бензпирена. Отличительной чертой бензпирена являются канцерогенные вещества. Действие они оказывают очень вредное. Например, вызывают онкологические заболевания.
Несмотря на вышесказанное, бензол является стартовым сырьем для производства разнообразных лекарственных препаратов, пластмасс, резины синтетического происхождения и, конечно же, красителей. Это самое распространённое детище химии и ароматическое соединение.
Ароматические углеводороды – соединения углерода и водорода, в молекуле которых имеется бензольное кольцо. Важнейшими представителями ароматических углеводородов являются бензол и его гомологи – продукты замещения одного или более атомов водорода в молекуле бензола на углеводородные остатки.
Строение молекулы бензола
Первое ароматическое соединение – бензол – было открыто в 1825 г. М. Фарадеем. Была установлена его молекулярная формула – С 6 Н 6. Если сравнить его состав с составом предельного углеводорода, содержащего такое же количество атомов углерода, — гексаном (С 6 Н 14), то можно заметить, что бензол содержит на восемь атомов водорода меньше. Как известно, к уменьшению количества атомов водорода в молекуле углеводорода приводит появление кратных связей и циклов. В 1865 г. Ф. Кекуле предложил его структурную формулу как циклогексантриена – 1, 3, 5.

Таким образом, молекула, соответствующая формуле Кекуле
, содержит двойные связи, следовательно, бензол должен иметь ненасыщенный характер, т. е. легко вступать в реакции присоединения: гидрирования, бромирования, гидратации и т. д.
Однако данные многочисленных экспериментов показали, что бензол вступает в реакции присоединения только в жестких условиях (при высоких температурах и освещении), устойчив к окислению. Наиболее характерными для него являются реакции замещения, следовательно, бензол по характеру ближе к придельным углеводородам.
Пытаясь объяснить эти несоответствия, многие ученые предлагали различные варианты структуры бензол. Окончательно строение молекулы бензола было подтверждено реакцией его образования из ацетилена. В действительности углерод — углеродные связи в бензоле равноценны, и их свойства не похожи на свойства ни одинарных, ни двойных связей.
В настоящее время бензол обозначают или формулой Кекуле, или шестиугольником, в котором изображают окружность.
![]()
Так в чем же особенность структуры бензола? На основании данных исследователей и расчетов сделан вывод о том, что все шесть углеродных атомов находятся в состоянии sp 2 -гибридизации и лежат в одной плоскости. Негибридизированные p -орбитали атомов углерода, составляющие двойные связи (формула Кекуле), перпендикулярны плоскости кольца и параллельны друг другу.
Они перекрываются между собой, образуя единую π-систему. Таким образом, система чередующихся двойных связей, изображенных в формуле Кекуле, является циклической системой сопряженных, перекрывающихся между собой -связей. Эта система представляет собой две тороидальные (похожие на бублик) области электронной плотности, лежащие по обе стороны бензольного кольца. Так, изображать бензол в виде правильного шестиугольника с окружностью в центре (π -система) более логично, чем в виде циклогексатриена-1,3,5.
Американский ученый Л. Полинг предложил представлять бензол в виде двух граничных структур, отличающихся распределением электронной плотности и постоянно переходящих друг в друга, т. е. считать его промежуточным соединением, «усреднением» двух структур.
Данные измерения длин связей подтверждают эти предположения. Выяснено, что все С-С связи в бензоле имеют одинаковую длину (0,139 нм). Они несколько короче одинарных С-С связей (0,154 нм) и длиннее двойных (0,132 нм).
Существуют также соединения, молекулы которых содержат несколько циклических структур.

Изомерия и номенклатура
Для гомологов бензола характерна изомерия положения нескольких заместителей . Простейший гомолог бензола - толуол (метилбензол) — не имеет таких изомеров; следующий гомолог представлен в виде четырех изомеров:

Основой названия ароматического углеводорода с небольшими заместителями является слово бензол
. Атомы в ароматическом кольце нумеруют, начиная от старшего заместителя к младшему:

По старой номенклатуре положения 2 и 6 называют ортоположениями
, 4 - пара-
, а 3 и 5 - метаположениями.
Физические свойства
Бензол и его простейшие гомологи в обычных условиях весьма токсичные жидкости с характерным неприятным запахом. Они плохо растворяются в воде, но хорошо - в органических растворителях.
Химические свойства бензола
Реакции замещения
. Ароматические углеводороды вступают в реакции замещения.
1. Бромирование.
При реакции с бромом в присутствии катализатора, бромида железа (ΙΙΙ), один из атомов водорода в бензольном кольце может замещаться на атом брома:

2. Нитрирование бензола и его гомологов . При взаимодействии ароматического углеводорода с азотной кислотой в присутствии серной (смесь серной и азотной кислот называют нитрующей смесью) происходит замещение атома водорода на нитрогруппу -NO 2:

Восстановлением образовавшегося в этой реакции нитробензола получают анилин — вещество, которое применяется для получения анилиновых красителей:

Эта реакция носит имя русского химика Зинина.
Реакции присоединения.
Ароматические соединения могут вступать и в реакции присоединения к бензольному кольцу. При этом образуются циклогексан или его производные.
1. Гидрирование
. Каталитическое гидрирование бензола протекает при более высокой температуре, чем гидрирование алкенов:
![]()
2. Хлорирование. Реакция идет при освещении ультрафиолетовым светом и является свободнорадикальной:

Гомологи бензола
Состав их молекул отвечает формуле С n H 2 n-6 . Ближайшие гомологи бензола:
Все следующие за толуолом гомологи бензола имеют изомеры. Изомерия может быть связана как с числом и строением заместителя (1, 2), так и с положением заместителя в бензольном кольце (2, 3, 4). Соединения общей формулы С 8 Н 10:

По старой номенклатуре, употребляемой для указания относительного расположения двух одинаковых или разных заместителей в бензольном кольце, используют приставки орто
— (сокращенно о-) – заместители расположены у соседних атомов углерода, мета-
(м
-) – через один атом углерода и пара
— (п
-) – заместители друг против друга.
Первые члены гомологического ряда бензола – жидкости со специфическим запахом. Они легче воды. Являются хорошими растворителями.
Гомологи бензола вступают в реакции замещения (бромирование, нитрирование). Толуол окисляется перманганатом при нагревании:

Гомологи бензола используются как растворители, для получения красителей, средств для защиты растений, пластмасс, лекарств.



















Циклическую структуру бензола впервые предложил Ф.А. Кекуле в 1865 г.

Фридрих Август Кекуле фон Страдониц - выдающийся немецкий химик XIX в. В 1854 г. он обнаружил первое органическое соединение, содержащее серу - тиоуксусную кислоту (тиоэтановую кислоту). Кроме того, он установил структуру диазосоединений. Олнако его наиболее известным вкладом в развитие химии является установление структуры бензола (1866). Кекуле показал, что двойные связи бензола чередуются по кольцу (эта идея впервые возникла у него во сне). Позже он показал, что два возможных расположения двойных связей идентичны и что бензольное кольцо представляет собой гибрид между этими двумя структурами. Таким образом, он предвосхитил представление о резонансе (мезомерии), которое появилось в теории химической связи в начале 1930-х гг.
Если бы бензол действительно имел такую структуру, то его 1,2-дизамещенные производные должны были иметь по два изомера. Например,

Однако ни у одного из 1,2-дизамещенных бензолов не удается выделить два изомера.
Поэтому впоследствии Кекуле предположил, что молекула бензола существует как две быстро переходящие друг в друга структуры:

Заметим, что в таких схематических изображениях молекул бензола и их производных обычно не указываются атомы водорода, присоединенные к углеродным атомам бензольного кольца.
В современной химии молекулу бензола рассматривают как резонансный гибрид из этих двух предельных резонансных форм (см. разд. 2.1). Другое описание молекулы бензола основано на рассмотрении ее молекулярных орбиталей. В разд. 3.1 было указано, что -электроны, находящиеся на -связывающих орбиталях, делокализованы между всеми атомами углерода бензольного кольца и образуют -электронное облако. В соответствии с таким представлением молекулу бензола можно условно изобразить следующим образом:
Экспериментальные данные подтверждают наличие у бензола именно такой структуры. Если бы бензол имел структуру, которую предположил первоначально Кекуле, с тремя сопряженными двойными связями, то бензол должен был вступать в реакции присоединения подобно алкенам. Однако, как было уже указано выше, бензол не вступает в реакции присоединения. Кроме того, бензол обладает большей устойчивостью, чем если бы он имел три изолированные двойные связи. В разд. 5.3 было указано, что энтальпия гидрирования бензола с образованием циклогексана имеет большее отрицательное
Таблица 18.3. Длина различных углерод-углеродных связей


Рис. 18.6. Геометрическое строение молекулы бензола.
значение, чем утроенная энтальпия гидрирования циклогексена. Разность этих величин принято называть энтальпией делокализации, резонансной энергией или энергией стабилизации бензола.
Все углерод-углеродные связи в бензольном кольце имеют одинаковую длину, которая меньше, чем длина связей С-С в алканах, но больше, чем длина связей С=С в алкенах (табл. 18.3). Это служит подтверждением тому, что углерод-углеродные связи в бензоле представляют собой гибрид между простыми и двойными связями.
Молекула бензола имеет плоскую структуру, которая изображена на рис. 18.6.
Физические свойства
Бензол при нормальных условиях - бесцветная жидкость, которая замерзает при 5,5 °С и кипит при 80 °С. Он имеет характерный приятный запах, но, как указывалось выше, сильно токсичен. Бензол не смешивается с водой и в системе бензол вода образует верхний из двух слоев. Однако он растворяется в неполярных органических растворителях и сам является хорошим растворителем других органических соединений.
Химические свойства
Хотя бензол вступает в определенные реакции присоединения (см. ниже), он не проявляет в них типичной для алкенов реакционной способности. Например, он не обесцвечивает бромную воду или раствор -ионов. Кроме того, бензол не
вступает в реакции присоединения с сильными кислотами, например с соляной или серной кислотой.
Вместе с тем бензол принимает участие в целом ряде реакций электрофильного замещения. Продуктами реакций этого типа являются ароматические соединения, поскольку в этих реакциях сохраняется делокализованная -электронная система бензола. Общий механизм замещения атома водорода на бензольном кольце каким-либо электрофилом описан в разд. 17.3. Примерами электрофильного замещения бензола являются его нитрование, галогенирование, сульфирование и реакции Фриделя-Крафтса.
Нитрование. Бензол можно нитровать (вводить в него группу ), обрабатывая его смесью концентрированных азотной и серной кислот:

Нитробензол
Условия проведения этой реакции и ее механизм описаны в разд. 17.3.
Нитробензол бледно-желтая жидкость с характерным миндальным запахом. При нитровании бензола кроме нитробензола образуются еще кристаллы 1,3-динитробензола, который является продуктом следующей реакции:

Галогенирование. Если смешать бензол в темноте с хлором или бромом, не произойдет никакой ракции. Однако в присутствии катализаторов, обладающих свойствами кислот Льюиса, в таких смесях протекают реакции электрофильного замещения. Типичными катализаторами этих реакций являются бромид железа (III) и хлорид алюминия. Действие этих катализаторов заключается в том, что они создают поляризацию в молекулах галогенов, которые затем образуют комплекс с катализатором:
хотя прямых доказательств того, что при этом образуются свободные ионы не существует. Механизм бромирования бензола с помощью бромида железа (III) в роли переносчика ионов можно представить следующим образом:

Сульфирование. Бензол можно сульфировать (замещать в нем атом водорода на сульфогруппу) путем кипячения с обратным холодильником в течение нескольких часов его смеси с концентрированной серной кислотой. Вместо этого бензол можно осторожно нагревать в смеси с дымящей серной кислотой. Дымящая серная кислота содержит триоксид серы. Механизм этой реакции можно представить схемой

Реакции Фриделя-Крафтса. Реакциями Фриделя-Крафтса первоначально называли реакции конденсации между ароматическими соединениями и алкилгалогенидами в присутствии катализатора-безводного хлорида алюминия.
В реакциях конденсации две молекулы реагентов (или одного реагента) соединяются между собой, образуя молекулу нового соединения, при этом от них отщепляется (элиминирует) молекула какого-либо простого соединения, например воды или хлороводорода.
В настоящее время реакцией Фриделя-Крафтса называют любое электрофильное замещение ароматического соединения, в котором роль электрофила играет какой-либо карбкатион или сильно поляризованный комплекс с положительно заряженным атомом углерода. Электрофильным агентом, как правило, служит алкилгалогенид или хлорид какой-либо карбоновой кислоты, хотя точно так же им может быть, например, алкен либо спирт. В качестве катализатора этих реакций обычно используется безводный хлорид алюминия. Реакции Фриделя-Крафтса принято подразделять на два типа: алкилирование и ацилирование.
Алкилирование. В реакциях Фриделя-Крафтса этого типа происходит замещение одного или нескольких атомов водорода в бензольном кольце на алкильные группы. Например, при осторожном нагревании смеси бензола с хлорометаном в присутствии безводного хлорида алюминия образуется метилбензол. Хлорометан играет в этой реакции роль электрофильного агента. Он поляризуется хлоридом алюминия таким же образом, как это происходит с молекулами галогенов:
Механизм рассматриваемой реакции может быть представлен следующим образом:

Следует обратить внимание на то, что в этой реакции конденсации между бензолом и хлорометаном происходит отщепление молекулы хлороводорода. Отметим также, что реальное существование метального карбкатиона в виде свободного иона сомнительно.
Алкилирование бензола хлорометаном в присутствии катализатора - безводного хлорида алюминия не завершается образованием метилбензола. В этой реакции происходит дальнейшее алкилирование бензольного кольца, приводящее к образованию 1,2-диметилбензола:

Ацилирование. В реакциях Фриделя-Крафтса этого типа происходит замещение атома водорода в бензольном кольце на ацильную группу, в результате чего образуется ароматический кетон.
Ацильная группа имеет общую формулу
Систематическое название ацильного соединения образуется путем замены суффикса и окончания -овая в названии соответствующей карбоновой кислоты, производным которой является данное ацилъное соединение, на суффикс -(о) ил. Например

Ацилирование бензола проводится с помощью хлорида или ангидрида какой-либо карбоновой кислоты в присутствии катализатора-безводного хлорида алюминия. Например

Эта реакция представляет собой конденсацию, в которой происходит отщепление молекулы хлороводорода. Отметим также, что название «фенил» часто используется для обозначения бензольного кольца в соединениях, где бензол не является главной группой:

Реакции присоединения. Хотя для бензола наиболее характерны реакции электрофильного замещения, он вступает также в некоторые реакции присоединения. С одной из них мы уже познакомились. Речь идет о гидрировании бензола (см. разд. 5.3). При пропускании смеси бензола с водородом над поверхностью тонкоизмельченного никелевого катализатора при температуре 150-160 °С происходит целая последовательность реакций, которая завершается образованием циклогексана. Суммарное стехиометрическое уравнение этой реакции можно представить следующим образом:

Под действием ультрафиолетового излучения или прямого солнечного света бензол вступает также в реакцию присоединения с хлором. Эта реакция осуществляется по сложному радикальному механизму. Ее окончательным продуктом является 1,2,3,4,5,6-гексахлороциклогексан:

Аналогичная реакция протекает между бензолом и бромом под действием ультрафиолетового излучения или солнечного света.
Окисление. Бензол и бензольное кольцо в других ароматических соединениях, вообще говоря, устойчивы к окислению даже такими сильными окислителями, как кислый или щелочный раствор перманганата калия. Однако бензол и другие ароматические соединения сгорают в воздухе или в кислороде с образованием очень дымного пламени, что характерно для углеводородов с высоким относительным содержанием углерода.

